| 主题 : RDPAC药品注册法规手册(2024版) |
级别: 版主
 |
1# 发表于:2024-12-17 09:06:12 IP:39.89.*.*
药品注册法规手册(2024版),收载截至2023年年底中国官方发布的注册相关法规。
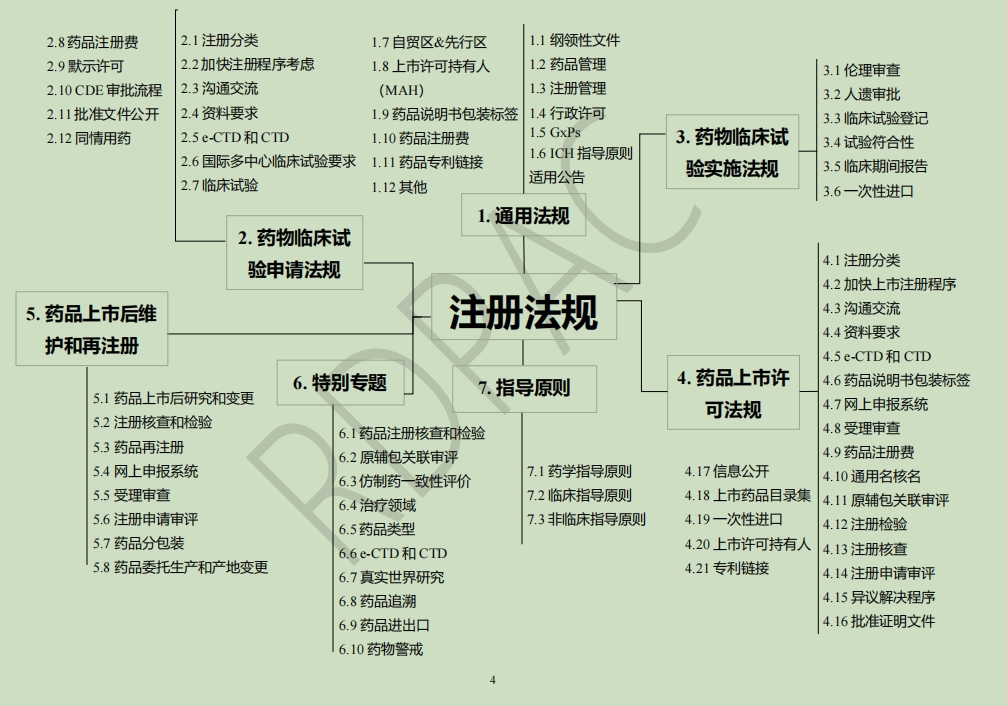
为了持续支持业界同仁及时获得药品注册相关的法规政策,准确把握药品注册法规环境的变化趋势,RDPAC 成员公司编撰并发布《药品注册法规手册》第 5 版。该版手册是在 2023 年《药品注册法规手册》第 4 版的基础上进行更新,涉及截至 2023 年年底中国官方发布的注册相关法规。 本手册属于参考资料,所列法规均来源于中国官方网站,每条法规均添加有“超级链接”到其发布的官方网站,本手册仅用于学习与交流。 本手册精选千余条中国官方公布法规,涉及国家纲领性文件、药品管理法规、药品注册法规和技术指导原则等多方面,并按照药品临床试验申请、临床试验实施、上市许可申请程序以及上市后维护和再注册等进行汇总分类,同时结合目前国家药品审评审批改革方向和行业热点,设置特别专题章节,是一部内容丰富的参考书。 本手册收集的这些法规和技术指导原则,对于制药企业和从事药品注册事务及药品研发的专业人士来说都是非常宝贵的信息资源,将使各有关单位及其读者较全面地了解中国药品的监管模式和审评体系,对工作和学习均具有积极的意义。 由于历年机构改革,部分法规颁布部门的名称与职能有所变化,本手册中大部分采用其现有名称;本手册包括了法规的发布日期及法规正式稿的实施日期;已经发布正式稿者,不再体现其征求意见稿;为更好的理解各章节的法规体系和法规变化,本手册设有法规鱼骨图概览和章节总结等。 考虑到还会有更多的法规和指导原则相继出台,本手册将持续更新,欢迎大家提出宝贵建议! RDPAC药品注册法规手册(2024版) |
||
|---|---|---|---|
1
共1页

